
黃精因其優(yōu)異的生物活性而被廣泛應(yīng)用。本研究以黃精為原料制備了一種新的黃精多糖。通過(guò)單糖組成分析,PSP主要由果糖和葡萄糖組成,摩爾比為93.81:5.12。鑒定出主要的連鎖類型為α-D-Glcp1→和→2-β-D-Fruf-1→。模擬唾液和胃腸消化后,PSP分子量無(wú)明顯變化。然而,PSP可以被腸道細(xì)菌分解。我們的研究結(jié)果表明,PSP管理增加了益生菌如雙歧桿菌的豐度。此外,腸道微生物可以利用PSP產(chǎn)生短鏈脂肪酸,包括乙酸、丙酸和丁酸。PSP發(fā)酵液對(duì)DPPH、超氧自由基、羥基自由基等自由基均有較好的清除作用。綜上所述,本研究將有助于促進(jìn)PSP作為益生元在功能食品和醫(yī)療行業(yè)的應(yīng)用。
1. 介紹
益生元是一種不可消化的成分,通過(guò)腸道微生物的代謝調(diào)節(jié)腸道菌群的組成或活性,從而對(duì)宿主產(chǎn)生有益的生理作用。近年來(lái),植物多糖的益生元潛力受到廣泛關(guān)注,主要包括菊粉、低聚果糖、阿拉伯木聚糖和各種膳食纖維。益生元可特異性促進(jìn)腸道益生菌如乳桿菌、雙歧桿菌的生長(zhǎng)。這些來(lái)自植物的益生元可以被結(jié)腸內(nèi)的腸道菌群發(fā)酵,細(xì)菌將多糖分解成低聚糖、短鏈脂肪(SCFAs)等產(chǎn)物,有助于宿主的健康。黃精屬百合科,作為一種具有藥用和食用雙重用途的植物,具有豐富的食物用途。而且,根莖在日常生活中,它也被用來(lái)制作草藥酒或煮成茶的替代品。在一些地區(qū),人們將黃精根莖作為添加劑添加到蛋糕或調(diào)味料中。此外,還能刺激唾液和胃液分泌,保護(hù)呼吸系統(tǒng),促進(jìn)食欲,增強(qiáng)免疫力。木犀草主要由甾體皂苷、類黃酮[8]、生物堿[9]、木脂素、氨基酸、多糖等組成。尤其是主成分,即黃精(Polygonatum sibiricum polysaccharides, PSP),據(jù)報(bào)道具有降血糖、抗癌、抗氧化、抗炎和抗骨質(zhì)疏松等作用。
通常,多糖經(jīng)胃腸道消化后,其化學(xué)結(jié)構(gòu)、分子量和生物活性都會(huì)發(fā)生顯著變化。例如,胃腸道內(nèi)消化酶和pH值的變化可能會(huì)影響多糖攝入后的理化性質(zhì)。然而,對(duì)于那些具有益生元作用的多糖,它們?cè)谏舷朗菬o(wú)法消化的,如Gracilaria rubra polysaccharides (GRPS)和Lycium barbarum polysaccharides (LBPS)。到目前為止,宿主分泌的消化酶是否能分解腸道內(nèi)的PSP尚不清楚。……,PSP在胃腸道中的消化特性及其對(duì)宿主腸道菌群組成的影響仍有待進(jìn)一步研究。
本研究旨在探討PSP在體外唾液-胃腸消化和隨后的人體糞便發(fā)酵過(guò)程中理化性質(zhì)的變化。采用水提醇沉法制備了PSP,并對(duì)其理化性質(zhì)進(jìn)行了研究。接下來(lái),我們研究了模擬唾液-胃腸消化過(guò)程中PSP的動(dòng)態(tài)特性。通過(guò)體外發(fā)酵模型,探討PSP對(duì)人體腸道菌群發(fā)酵及其代謝物(SCFAs)產(chǎn)生的影響。并對(duì)PSP發(fā)酵產(chǎn)物的抗氧化活性進(jìn)行了研究。
2、研究結(jié)果
1)PSP的物理化學(xué)性質(zhì)
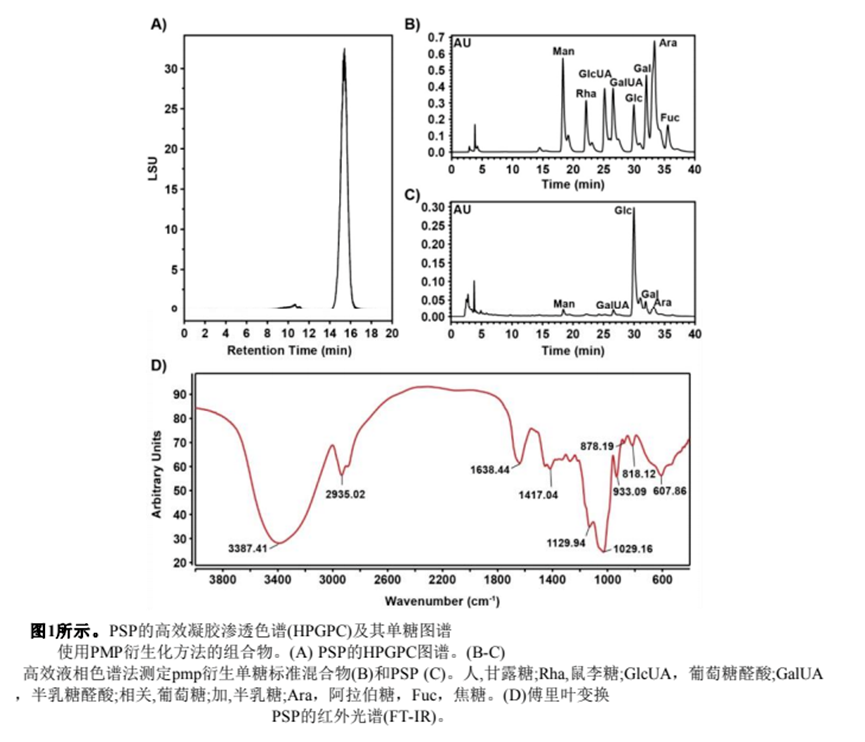
我們分析了PSP的理化性質(zhì),結(jié)果表明,PSP的總碳水化合物含量豐富,還原糖、蛋白質(zhì)和醛酸含量低。PSP的色譜圖顯示為一個(gè)對(duì)稱的單峰,從分子量分布來(lái)看,它是均勻的。HPGPC法測(cè)定PSP分子量為3.06 kDa。由于PMP衍生化法對(duì)果糖結(jié)構(gòu)造成破壞,因此在PSP的HPLC色譜圖中沒(méi)有出現(xiàn)果糖峰。間苯二酚法測(cè)定PSP中果糖含量為93.81%。PSP的剩余單糖組成如圖1C所示,包含葡萄糖(5.12%)、甘露糖(0.15%)、半乳糖(0.5%)、阿拉伯糖(0.21%)和半乳糖醛酸(0.21%)。這些數(shù)據(jù)表明PSP是一種以果糖為主要單糖的雜多糖。

2 )PSP的FT-IR光譜分析
從圖1D PSP的FT-IR光譜可以看出,3387.41 cm1處的強(qiáng)烈吸收峰主要是O - H的拉伸振動(dòng)引起的,2935.02 cm-1處是C - H的吸收峰,兩者都是多糖的特征吸收峰。在1638.44 cm-1、1417.04 cm-1、1129.94 cm-1和1029.16 cm-1處的吸收峰分別歸屬于C=O、COOH、C * * * OH、C * * * * * * C的拉伸振動(dòng),提示糖醛酸和吡喃環(huán)的存在(圖1D)。878.19 cm-1處的吸收峰歸屬于α型糖苷鍵。此外,933.09 cm-1和818.12 cm-1處的吸收峰歸屬于具有β型糖苷鍵的呋喃糖環(huán)(圖1D)。
3) 甲基化法測(cè)定PSP糖渣
為了確定PSP中糖苷鍵的類型,我們用GC-MS對(duì)PSP的部分甲基化糖醇乙酸酯(PMAAs)進(jìn)行了甲基化分析。結(jié)果表明,PSP衍生物含有兩個(gè)PMAAs(補(bǔ)充圖1A)。PSP總離子色譜(TIC)的峰1被鑒定為T(mén)erminal-D-glucopyranosyl(補(bǔ)充圖1B和補(bǔ)充表1)。甲基化分析中果糖的糖苷鍵類型尚不清楚,將結(jié)合NMR分析推斷。
4 )PSP的核磁共振(NMR)分析
利用一維和二維NMR譜分析了PSP的結(jié)構(gòu)。PSP的1H NMR譜如圖2A所示。由于酮糖沒(méi)有端粒質(zhì)子,因此在端粒質(zhì)子區(qū)只出現(xiàn)δ 5.43 ppm的單一信號(hào),該信號(hào)被分配給α- d -葡萄糖醛酸殘基的H-1。大部分質(zhì)子信號(hào)集中在δ 3.4±4.4 ppm。結(jié)果表明,PSP中既有α-構(gòu)型(δ > 5.0 ppm),也有β構(gòu)型(δ < 5.0 ppm),且以β-構(gòu)型為主Z.H. Qi et al. / Food Science and Human Wellness 13 (2024)FT-IR分析(圖1D)。在13C NMR譜(圖2B)中,大多數(shù)碳信號(hào)來(lái)自δ 60±110 ppm區(qū)域。在δ 103.6 ppm的端粒碳區(qū)觀察到的信號(hào)被分配到果糖殘留物的典型峰(C-2)。根據(jù)1H1H COSY和HSQC光譜(圖2C和2D)對(duì)果糖殘基的氫信號(hào)進(jìn)行分配。13C NMR譜(圖2B)中δ 60.43 ppm、δ 76.72 ppm、δ74.33 ppm、δ 81.06 ppm和δ 62.24 ppm的碳信號(hào)分別對(duì)應(yīng)果糖殘基的C-1、C-3、C-4、C-5和C-6。此外,葡萄糖殘基的碳信號(hào)較弱,在13C NMR譜中未被識(shí)別,這與PSP中葡萄糖含量較低一致(表1)。最后,糖殘基的1H和13C化學(xué)位移信號(hào)總結(jié)如表2所示。
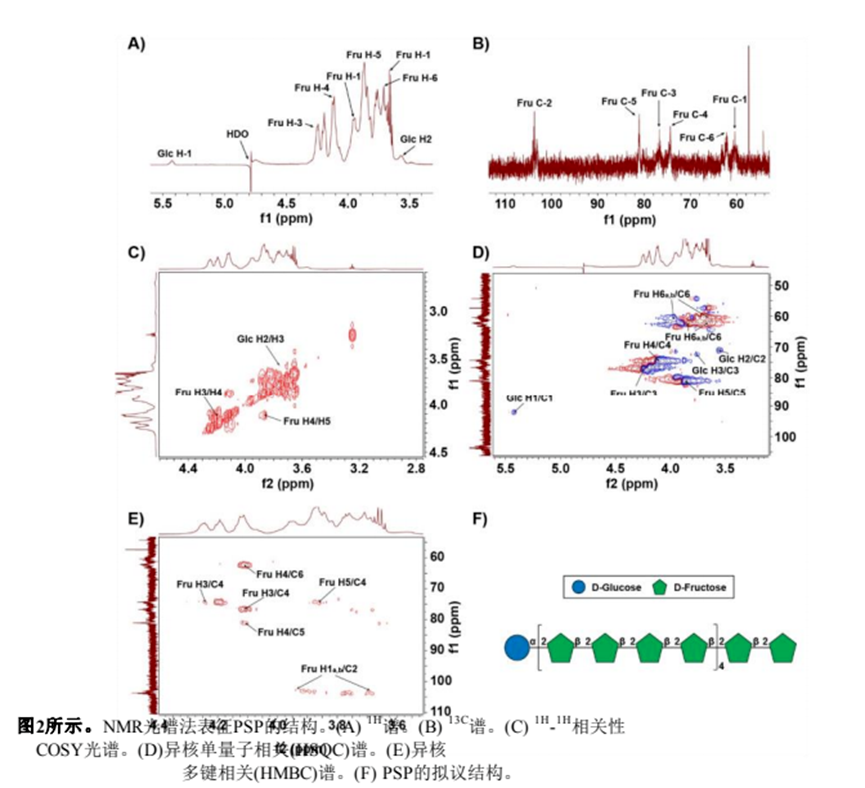
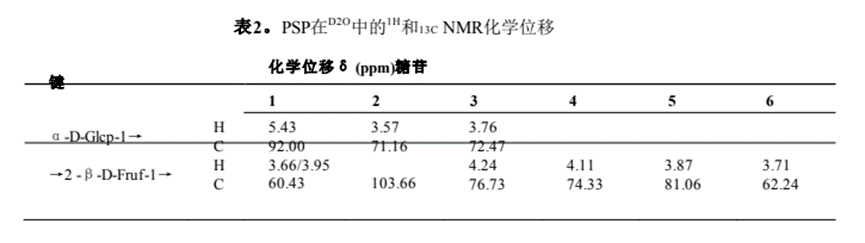
通過(guò)HMBC光譜中的相關(guān)峰確定PSP中糖殘基的序列和連鎖位點(diǎn)(圖2E)。果糖殘基氫信號(hào)H-1 (δ 3.66, 3.95 ppm)和碳信號(hào)C-2 (δ 103.66 ppm)有相關(guān)的信號(hào)峰,表明PSP中存在→2)-β- d - fruf -(1→2)-β- d - fruf -(1→2)鏈。通過(guò)甲基化分析和已報(bào)道的葡萄糖殘基NMR譜[25,26],我們推測(cè)葡萄糖殘基的鍵合形式為α-D-Glcp-(1→2)-β- d - fruf -(1→)。綜合分析單糖組成、FT-IR和NMR信息分析,我們提出了PSP的預(yù)測(cè)結(jié)構(gòu),如圖2F和補(bǔ)充圖2所示。
5) 模擬PSP體外消化
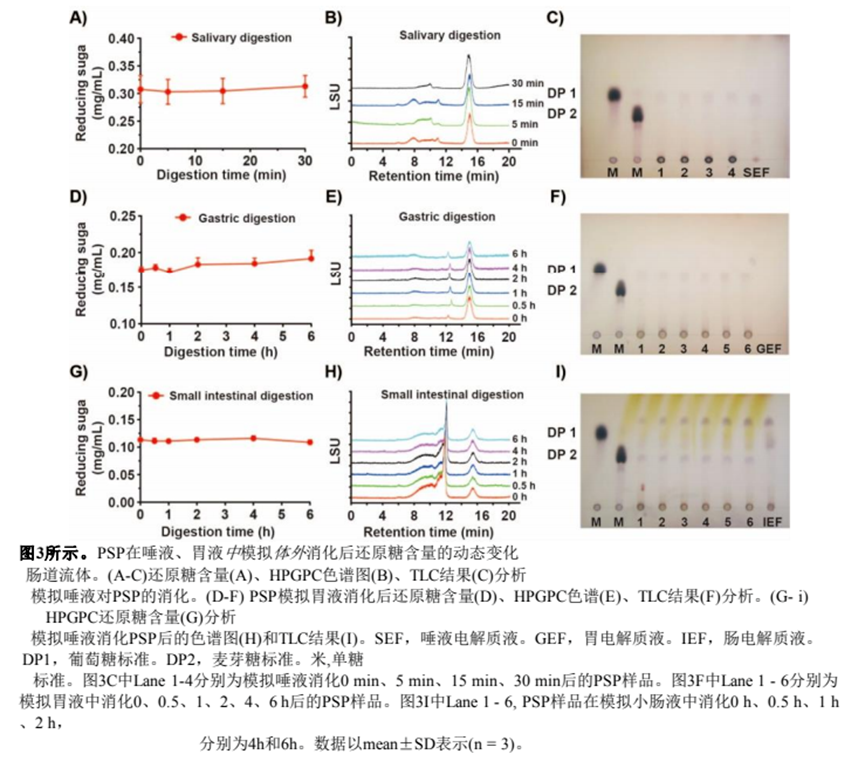
口腔作為食物攝入后的第一個(gè)消化部位,分泌α-淀粉酶,催化α-1,4糖苷鍵的水解[27]。為了觀察唾液是否能夠分解PSP,我們將PSP與模擬唾液溶液孵育0- 30min。如圖3A所示,整個(gè)消化過(guò)程中,消化液中的還原糖含量保持在0.31 mg/mL。同時(shí),不同時(shí)間消化后PSP的HPGPC譜沒(méi)有變化(圖3B)。TLC結(jié)果也是如此,表明唾液消化PSP沒(méi)有產(chǎn)生新的產(chǎn)物(圖3C)。總之,我們認(rèn)為唾液不能消化PSP,這意味著PSP中的糖苷鍵不能被α-淀粉酶水解。在口腔中初始消化后,食物會(huì)通過(guò)食道轉(zhuǎn)運(yùn)到胃中進(jìn)行后續(xù)消化。因此,我們將唾液消化的PSP溶液與模擬胃液孵育。如圖3D-F所示,在整個(gè)消化過(guò)程中,PSP的還原糖含量、HPGPC圖譜和TLC結(jié)果沒(méi)有發(fā)生變化。綜上所述,PSP在酸性條件下(pH 3.0)的胃液中沒(méi)有被分解。小腸是營(yíng)養(yǎng)物質(zhì)消化和吸收的主要部位,因此我們研究了小腸液是否可以分解PSP。如圖3G和3H所示,胃液消化PSP溶液與模擬小腸消化液孵育不同時(shí)間后,PSP的還原糖含量和HPGPC色譜均未見(jiàn)明顯變化。值得注意的是,TLC結(jié)果顯示,小腸液消化PSP后產(chǎn)生少量單糖。
6) PSP的體外發(fā)酵
考慮到腸道菌群可以通過(guò)糖苷水解酶代謝飼糧中的多糖[3,19],我們下一步研究了人類腸道菌群對(duì)PSP的發(fā)酵。
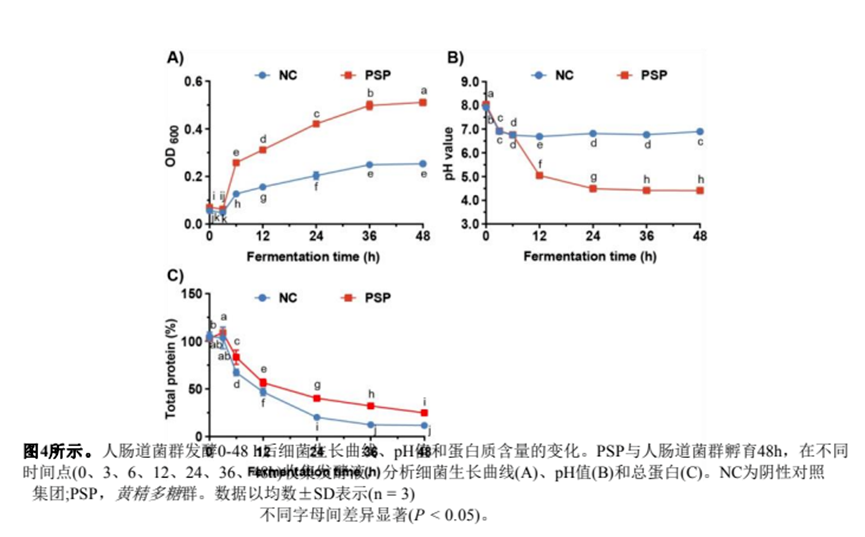
(6.1) PSP發(fā)酵液細(xì)菌生長(zhǎng)曲線、pH值及蛋白質(zhì)含量分析
我們首先檢測(cè)了發(fā)酵液中腸道菌群的生長(zhǎng)曲線。如圖4A所示,陰性對(duì)照(NC)組的吸光度值(OD600)在3 h時(shí)迅速上升,然后在36 h時(shí)達(dá)到生長(zhǎng)平臺(tái),吸光度值增加到0.25。與NC組相比,PSP組的OD600在36 h達(dá)到0.49,在48 h繼續(xù)上升到0.51(圖4A)。發(fā)酵6 h后,PSP組發(fā)酵液的OD600始終高于NC組。
細(xì)菌在代謝多糖時(shí)會(huì)產(chǎn)生酸性代謝物(如SCFAs和乳酸),導(dǎo)致腸道pH值降低,腸道菌群結(jié)構(gòu)改變。結(jié)果如圖4B所示表明,NC組發(fā)酵6 h后pH值降至6.7,并在后續(xù)發(fā)酵過(guò)程中保持穩(wěn)定。相比之下,PSP組在發(fā)酵過(guò)程中pH值顯著降低,在48 h時(shí)降至4.4(圖4)。
此外,我們檢測(cè)了發(fā)酵液中的總蛋白含量,在NC或PSP組的發(fā)酵過(guò)程中,總蛋白含量呈下降趨勢(shì)(圖4)。發(fā)酵48 h后,PSP組蛋白質(zhì)含量為24.9%,NC組蛋白質(zhì)含量為11.7%。
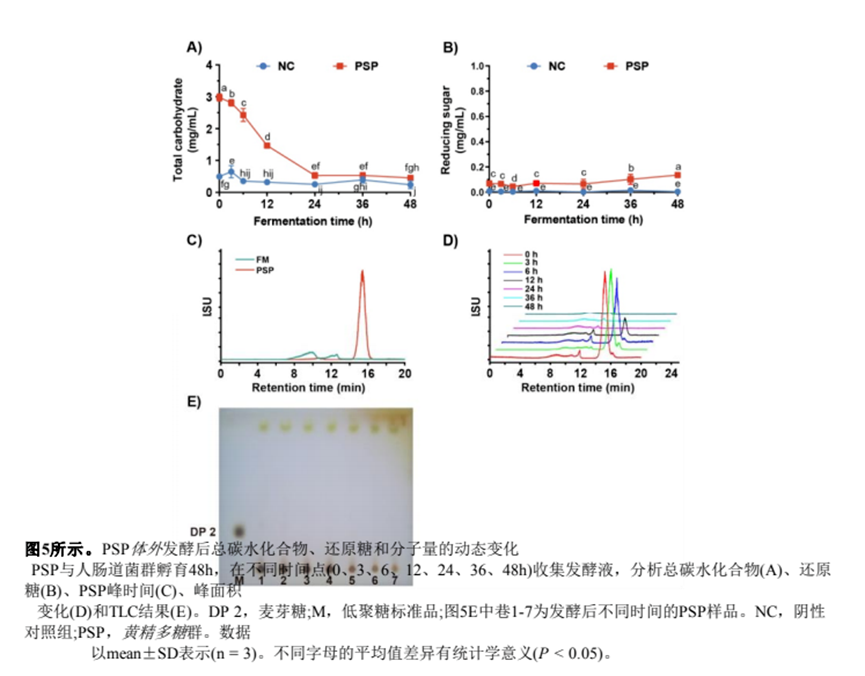
(6.2) 總碳水化合物、還原糖和分子量的動(dòng)態(tài)變化
進(jìn)一步,我們測(cè)試了發(fā)酵液中總碳水化合物的動(dòng)態(tài)變化。對(duì)于PSP組,發(fā)酵324 h后總碳水化合物迅速下降,最終在48 h時(shí)降至0.45 mg/mL(圖5A)。同時(shí),發(fā)酵過(guò)程中總碳水化合物的84.9%被腸道菌群利用。
由于來(lái)自腸道菌群的糖苷酶可以破壞多糖的糖苷鍵,從而增加還原糖的產(chǎn)生[29],我們比較了兩個(gè)實(shí)驗(yàn)組發(fā)酵液中還原糖含量的差異。如圖5B所示,在整個(gè)發(fā)酵過(guò)程中,NC組的糖含量沒(méi)有明顯變化。相比之下,PSP組的還原糖含量在48 h時(shí)增加到0.14 mg/mL(圖5)。
由于發(fā)酵液的復(fù)雜性,NC組的峰值出現(xiàn)在812 min,而PSP的峰值出現(xiàn)在15.3 min(圖5C)。同時(shí),我們用HPGPC分析了發(fā)酵液中不同時(shí)間點(diǎn)的PSP(圖5D)。結(jié)果表明,PSP峰面積隨濃度的增加而逐漸減小發(fā)酵時(shí)間。發(fā)酵24 h后,HPGPC譜顯示PSP的殘留量極低,表明PSP被腸道菌群分解。此外,TLC結(jié)果證實(shí)發(fā)酵液中總碳水化合物在發(fā)酵過(guò)程中明顯減少(圖5)。
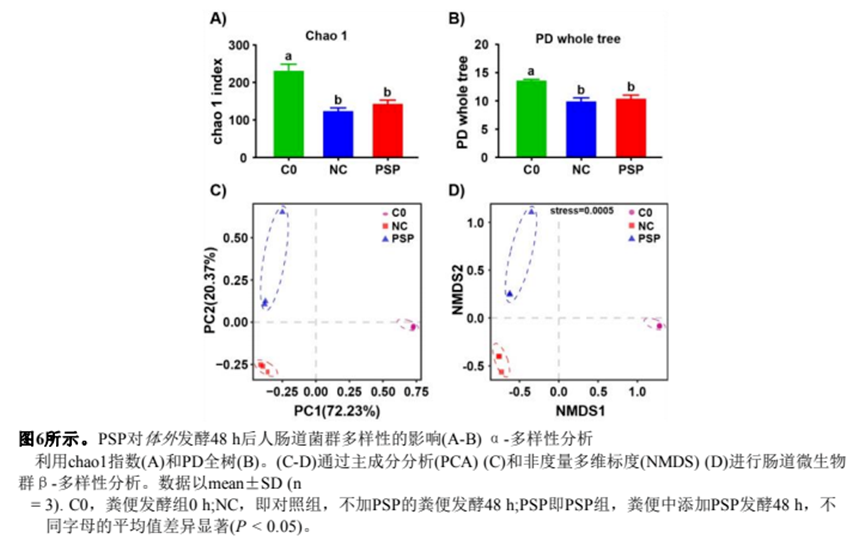
7 )PSP對(duì)腸道菌群組成的影響
為了評(píng)估PSP的益生元潛力,我們通過(guò)16S rDNA測(cè)序評(píng)估了PSP對(duì)體外腸道微生物群的影響。利用Chao 1和PD全樹(shù)指數(shù)進(jìn)行α-多樣性分析,PSP增強(qiáng)了腸道微生物群落的多樣性(圖6)。通過(guò)主成分分析(PCA)和非度量多維標(biāo)度(NMDS)的β-多樣性評(píng)估,將腸道菌群樣本劃分為三個(gè)不同的分類群,表明實(shí)驗(yàn)組之間腸道菌群分化良好(圖6)。
為了研究PSP對(duì)特定腸道菌群的調(diào)節(jié)作用,我們分析了各組腸道菌群的相對(duì)豐度變化。在門(mén)水平上,各組腸道菌群主要由厚壁菌門(mén)(Firmicutes)、擬桿菌門(mén)(Bacteroidetes)和變形菌門(mén)(Proteobacteria)組成,約占細(xì)菌群落總數(shù)的95%(圖7A)。與NC組相比,PSP顯著提高了變形菌門(mén)和放線菌門(mén)的比例(P < 0.05)(圖7A)。在科水平上,PSP增加了Veillonellaceae、Enterobacteriaceae和Alcaligenaceae的豐度(P < 0.05,與NC組相比)。相比之下,PSP降低了Bacteroidaceae和Clostridiaceae的含量(P < 0.05,與NC組相比)(圖7)。
接下來(lái),我們?cè)趯偎缴媳容^了NC組和PSP組腸道菌群的相對(duì)豐度差異。如圖7C所示,通過(guò)分層聚類熱圖分析了23個(gè)最易變的細(xì)菌屬。與NC組相比,PSP組增加了部分細(xì)菌的豐度(如蘇特菌和雙歧桿菌),減少了部分細(xì)菌的豐度(如擬桿菌和擬桿菌)(P < 0.05)。發(fā)酵48 h后,NC組的核心微生物為擬桿菌(Bacteroides)(29.7%)、擬桿菌(A listipes)(3.15%)和乳球菌(Lactococcus)(3.09%)(補(bǔ)充圖3)。PSP組以擬桿菌(Bacteroides)(17.2%)、微孔菌(Veillonella)(6.98%)、克雷伯菌(Klebsiella)(2.35%)和蘇特菌(Sutterella)(3.21%)為主(補(bǔ)充圖3)。

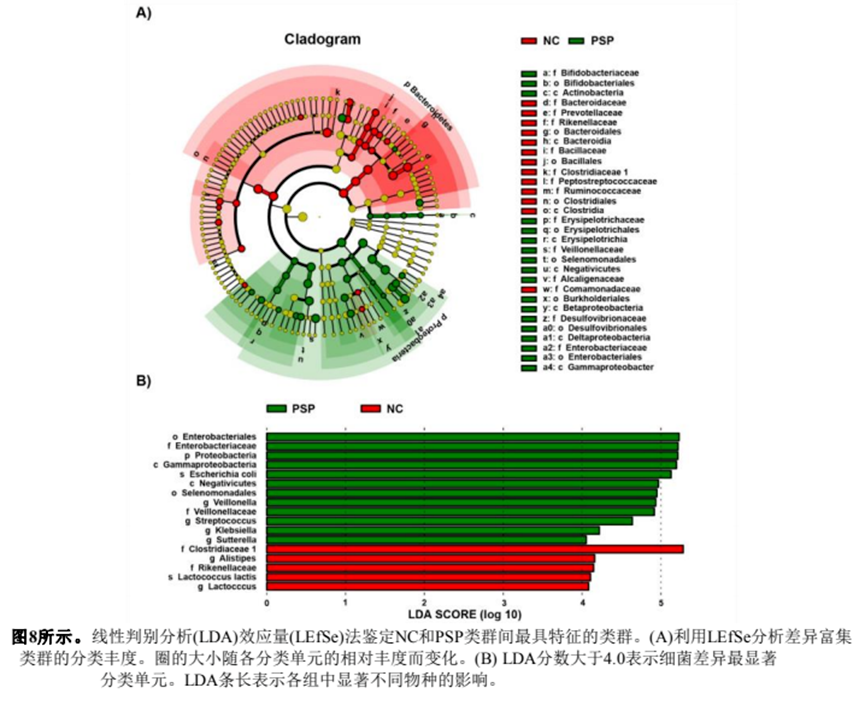
采用線性判別分析效應(yīng)量(LEfSe)方法對(duì)各試驗(yàn)組的特定細(xì)菌分類群進(jìn)行分析。如圖8A所示,PSP中的主要細(xì)菌是Proteobacteria分支,NC組中的特征細(xì)菌是Bacteroidetes,在碳水化合物的發(fā)酵中起著至關(guān)重要的作用。繪制LDA評(píng)分(log 10)直方圖,分析兩組優(yōu)勢(shì)菌。如圖8B所示,對(duì)照組的優(yōu)勢(shì)菌為f_Clostridiaceae 1、g_Alistipes、f_Rikenellaceae和g_Lactococcus。PSP組優(yōu)勢(shì)菌群為o_Enterobacteriales、p_Proteobacteria、c_Gammaproteobacteria等13種。
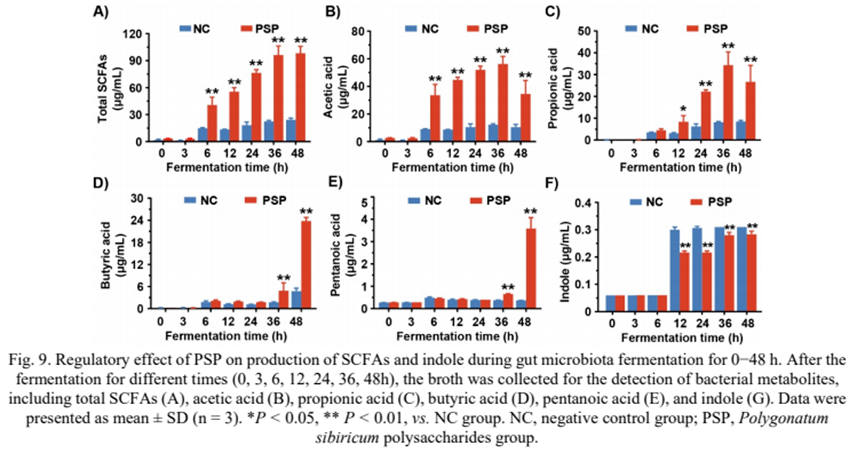
8) PSP對(duì)短鏈脂肪酸和吲哚生成的影響
由于短鏈脂肪酸和吲哚是攝入多糖后的主要細(xì)菌代謝物,我們?cè)诎l(fā)酵48 h后檢測(cè)了NC組和PSP組之間這兩種代謝物的含量。如圖9A所示,在發(fā)酵過(guò)程中,兩組的總短鏈脂肪酸水平均有所升高。PSP組總短鏈脂肪酸濃度由0 h時(shí)的(3.32±0.14)μg/mL升高至48 h時(shí)的(98.21±5.51)μg/mL,顯著高于NC組(P < 0.01)。結(jié)果表明,PSP促進(jìn)了腸道菌群中短鏈脂肪酸的產(chǎn)生。
其中,36 h時(shí),NC組乙酸濃度為(12.24±0.58)μg/mL, PSP組為(56.22±4.53)μg/mL(圖9B)。發(fā)酵3 ~ 48 h期間,PSP組乙酸水平顯著高于NC組(P < 0.01)(圖9B)。PSP組丙酸濃度在36 h達(dá)到(34.36±4.92)μg/mL(圖9C)。與上述兩種短鏈脂肪酸不同,丁酸和戊酸主要在腸道菌群發(fā)酵后期產(chǎn)生(圖9D和9E)。發(fā)酵48 h后,測(cè)定PSP組丁酸和戊酸含量分別為(23.82±0.67)μg/mL和(3.58±0.35)μg/mL。顯著高于NC組(圖9D和9E)。此外,我們通過(guò)GC-MS檢測(cè)吲哚的含量。結(jié)果表明,NC組與PSP組在發(fā)酵初期(0 ~ 6 h)吲哚濃度無(wú)顯著差異,但從發(fā)酵12 h開(kāi)始,NC組的吲哚濃度高于PSP組(P < 0.01)(圖9)。
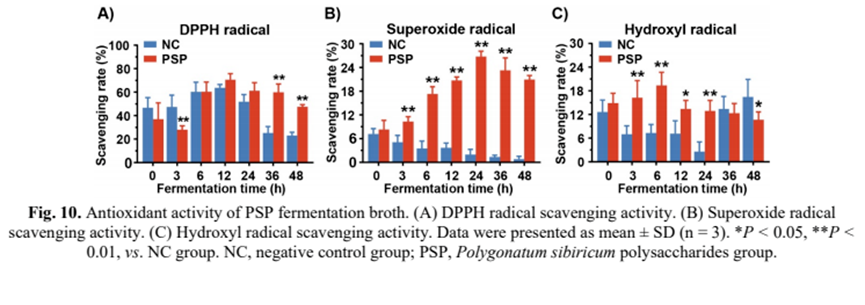
9) PSP發(fā)酵液的抗氧化活性
最后,我們考察了PSP發(fā)酵液對(duì)自由基的清除作用。與NC組相比,PSP發(fā)酵增強(qiáng)了腸道菌群對(duì)DPPH自由基的清除率(圖10A),在12 h時(shí)清除率最高可達(dá)70.59%。另一方面,PSP組的超氧自由基清除率逐漸提高,在24 h時(shí)達(dá)到峰值(26.76%)(圖10b)。總體而言,PSP組對(duì)超氧自由基的清除能力明顯高于PSP組。有趣的是,在發(fā)酵過(guò)程中,NC對(duì)超氧自由基的清除能力呈下降趨勢(shì)(圖10B)。此外,PSP組對(duì)羥基自由基的清除效果比NC組要好(圖10)。
3 結(jié)論
從黃精中分離得到分子量為3.06 kDa的果聚糖多糖。通過(guò)模擬消化和體外發(fā)酵的人體腸道菌群,我們證明了唾液、胃液和小腸消化液不能分解PSP。相比之下,腸道細(xì)菌顯示出較高的PSP代謝活性。在PSP發(fā)酵過(guò)程中,腸道菌群的多樣性和豐度受到顯著影響,同時(shí)大量產(chǎn)生乙酸、丙酸、丁酸和戊酸等短鏈脂肪酸。此外,PSP發(fā)酵液還具有清除自由基的作用。我們的研究揭示了將PSP作為一種潛在的益生元應(yīng)用于食品和制藥工業(yè)。
上文引用:Food Science and Human Wellness
ISSN 2097-0765e-ISSN 2213-4530 CN 10-1750/TS
Editor-in-Chief: Bin Cong
https://www.sciopen.com/article/10.26599/FSHW.2022.9250184
版權(quán):© 2024 北京食品科學(xué)研究院.